Solución Problema 2 de la Primera Ley de la Termodinámica
De forma similar al ejemplo anterior, en este problema de la primera ley de la termodinámica reforzamos el concepto principal que es la utilización correcta de la fórmula, con ello se proporciona la solución paso a paso del ejemplo y nuevamente el alumno comprueba sus resultados de manera correcta y concisa. ??
Nivel de Dificultad: ⭐⭐
Solución:
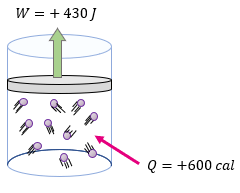
Antes de emplear la fórmula de la primera ley de la termodinámica, debemos asegurarnos de comprender el tema, ya que si no comprendemos el tema tendremos problemas más adelante. Por ejemplo, en el ejercicio nos dice que se le suministran 600 calorías al sistema, por lo que el signo deberá de ser positivo, y lo mismo el trabajo puesto que es el mismo sistema quien realiza el trabajo a sus alrededores.
- Obtener la variación de la energía interna del sistema
Datos:
$latex \displaystyle Q=600cal$
$latex \displaystyle W=430J$
a) Obtener la variación de energía interna
Primeramente vamos a convertir las calorías a Joules, haciendo uso de nuestro factor de conversión.
$latex \displaystyle 600cal\left( \frac{4.2J}{1cal} \right)=2520J$
Colocamos nuestra fórmula de la primera ley de la termodinámica
$latex \displaystyle \Delta U=Q-W$
Sustituyendo nuestros datos en la fórmula, obtenemos:
$latex \displaystyle \Delta U=2520J-430J=2090J$
Por lo que la variación de energía interna es de 2090 Joules
Solución:
$latex \displaystyle \Delta U=2090J$

Deja una respuesta