La teoría atómica
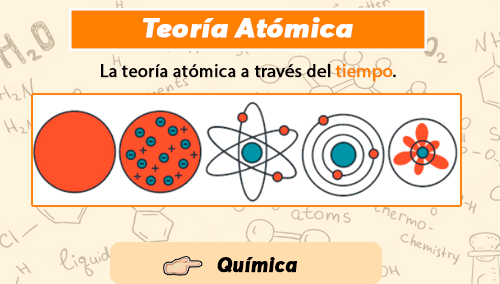
¿Qué tal lectores? hemos tratado de realizar nuestra primera publicación hablando sobre la teoría atómica, y los grandes desarrollos que esto vino a realizar en el mundo de la ciencia. Así que si estás preparado para realizar tus anotaciones, comprender parte de la historia, pon mucha atención 😀
Es en la antigua India donde surgen los primeros modelos que trataron de explicar cómo estaba compuesta la materia, de aquí desprende el primer filósofo que formuló ideas sobre el átomo de una manera sistemática fue Kanada. Además no fue el único, también estaba el gran Pakudha Katyayana, quien también vivió en el siglo VI a. C., fue otro filósofo que propuso ideas sobre la constitución atómica del mundo material.
Tuvo que pasar cierto tiempo para que llegar los Griegos y realizaron los primeros conceptos del átomo desarrollados en Occidente, éstos se acuñaron cerca del año 600 a.C., con grandes científicos como Tales de Mileto, Demócrito, Anaxímenes, Heráclito, Empédocles y Aristóteles, entre otros, mencionaron diferentes aspectos de la materia que de una u otra manera, referían a los átomos.
La teoría atomística de Leucipo y su discípulo Demócrito establece que:
- Los átomos son eternos, indivisibles, homogéneos e invisibles.
- Los átomos se diferencian en su forma y tamaño.
- Las propiedades de la materia varían según el agrupamiento de los átomos.
Esta teoría, al igual que todas las teorías filosóficas griegas, no apoya sus postulados mediante experimentos, sino que se explica a través razonamientos lógicos.
En el año 1660 el gran Robert Boyle en su obra “El químico escéptico” fue el primero en establecer el criterio moderno por el cual se define un elemento: una sustancia que puede combinarse con otros elementos para formar compuestos y que no puede descomponerse en una sustancia más simple.
A principio del siglo XVIII El modelo cinético de la materia surgió cuando el matemático suizo Daniel Bernoulli empleó el modelo de una esfera rígida para representar a las partículas que forman la materia.
Fue en 1789 cuando Antoine-Laurent de Lavoisier formula la primera fue la ley de conservación de la materia , en la que establecía que en toda reacción química la masa se conserva, es decir, la masa consumida de los reactivos es igual a la masa obtenida de los productos. Por lo tanto, la materia no se crea ni se destruye, sino que simplemente se transforma.
Llegó el año 1797 y el científico inglés John Dalton basado en sus trabajos siguientes y en sus propios experimentos, desarrolló una teoría atómica en la cual proponía que cada elemento químico estaba compuesto de un único átomo, y aunque no pueden ser alterados o destruidos por medios químicos, estos pueden combinarse para formar estructuras más complejas (compuestos químicos).
En 1811 el italiano Amadeo Avogadro, asumiendo que los gases estaban constituidos por partículas, propuso lo que actualmente se conoce como la Ley de Avogadro en la que argumentaba:
Por las décadas de 1860 y 1870 el escocés James C. Maxwell y el austriaco Ludwig Boltzmann desarrollaron la idea de que un gas está constituido por muchísimos átomos o moléculas, que pueden considerarse pequeñas esferas duras en movimiento continuo que colisionan entre sí y contra las paredes del recipiente que lo contiene. La importancia de estas ideas fue que el comportamiento de un gas podía ser explicado aplicando las leyes de Newton a las moléculas. En 1872, Boltzmann sentó las bases de lo que hoy se conoce como teoría cinética moderna.
En 1897 llegó Joseph John Thomson descubrió la existencia de los electrones y las cargas eléctricas que estos poseían (positivas o negativas).
En 1908 el premio Nobel de química, Ernest Rutherford, estudió las emisiones radioactivas e identificó los rayos alfa, beta y gamma. Esto lo llevó al descubrimiento de un nuevo modelo atómico en el que los átomos se dividen en un núcleo formado por neutrones y protones, y una corteza formada por electrones que giran alrededor del núcleo en órbitas circulares.
-
por fa mas articulos de quimica
-
hola! cuando compartiran mas articulos de quimica? es que siento que son pocos
4 Deja tu comentario
Deja una respuesta

Estos temas te pueden interesar