Ley de Gay-Lussac - Ejercicios Resueltos

Qué hay amigos, hoy hablaremos sobre otra ley muy importante en los gases y que de manera resumida y muy práctica la vamos a ver durante este post, así que toma asiento, cuaderno, lapicero y calculadora en mano que es momento de aprender algo nuevo, y eso algo nuevo es ni nada más ni nada menos que sobre la ley de gay-lussac .
bien, hasta este momento en el blog tenemos dos leyes relacionadas entre si que dan paso a ley general del estado gaseoso que se verá en otro post, por ahora ya se ha comprendido de que trata la ley de charles y la ley de boyle-mariotte y si no las has revisado pues no esperes más, y dales una checadita.
Entendiendo la Ley de Gay-Lussac
Vamos a lo que nos importa e interesa, esta ley tiene una particularidad en general al igual que las demás, por ejemplo; en la ley de charles la presión permanece constante, en la ley de boyle-mariotte es la temperatura quien permanece constante y para finalizar en la la ley de Gay-Lussac es el volumen quien permanece constante.
Antes de meternos en las matemáticas y fórmula de gay-lussac, veremos algo más sobre esta ley.
Aquí entenderemos porque la presión y temperatura van muy de la mano y son totalmente proporcionales, es decir, supongamos que acabas de comprar un aerosol, si sometemos ese aerosol a cierta temperatura de tal manera que aumente, la presión también aumentará, a esta relación se le llama proporcionalidad.

Notables científicos, físicos y químicos dedicaron parte de su tiempo para poder entender mejor esta ley, pero fue Gay-Lussac un físico-químico de origen Francés, que estudió a fondo el comportamiento de los gases respecto a la relación entre la presión y la temperatura, su ley estable lo siguiente.
Ahora si, vamos a lo matemático.
Fórmula de Gay-Lussac
Como dijimos texto atrás, la proporcionalidad que existe en esta ley es sobre la presión y la temperatura, matemáticamente colocaremos esto como:
$\displaystyle P\propto T$
Ahora introduzcamos una constante de proporcionalidad esto da paso a que se vea de la siguiente forma, es como un despeje simple.
$\displaystyle \frac{P}{T}=k$
Ahora al tratarse de una igualdad, podemos considerar las condiciones inicial y final, quedando la ecuación o fórmula matemática de la Ley de Gay-Lussac de la siguiente forma:
$\displaystyle \frac{{{P}_{1}}}{{{T}_{1}}}=\frac{{{P}_{2}}}{{{T}_{2}}}$
donde:
$\displaystyle {{P}_{1}}=$ Presión Inicial
$\displaystyle {{T}_{1}}=$ Temperatura Inicial
$\displaystyle {{P}_{2}}=$ Presión Final
$\displaystyle {{T}_{2}}=$ Temperatura Final
Gráfica de la Ley de Gay-Lussac
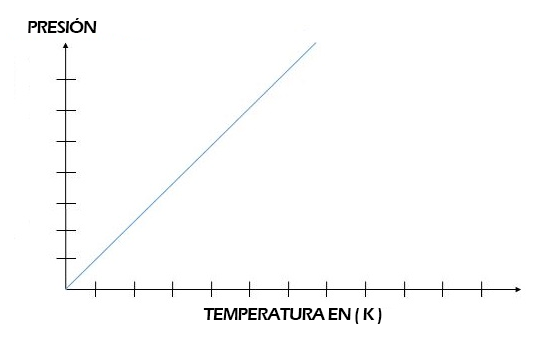
En la gráfica podremos observar claramente la proporcionalidad entre la presión y la temperatura, recordemos también que para las condiciones de un gas, las temperaturas deben darse en grados Kelvin.
Ejemplos resueltos de la Ley de Gay-Lussac
Solución: Si leemos detalladamente el problema nos podremos dar cuenta que las condiciones iniciales de temperatura y presión nos las dan como datos, al igual que la presión final, pero el único dato que no nos dan es la temperatura final, y la cual nos piden en °C.
Vamos a colocar nuestros datos:
$\displaystyle {{P}_{1}}=$ 440 mm de Hg.
$\displaystyle {{T}_{1}}=$ 35°C + 273 = 308 °K
$\displaystyle {{P}_{2}}=$ 760 mm de Hg.
$\displaystyle {{T}_{2}}=$ ?
He sumado a 35° la cantidad de 273, para poder hacer la conversión a grados Kelvin. Es muy importante que lo conviertan sino no dará el resultado que esperamos.
Ahora, usamos la fórmula para esta ley, la cual colocaré de nuevo.
$\displaystyle \frac{{{P}_{1}}}{{{T}_{1}}}=\frac{{{P}_{2}}}{{{T}_{2}}}$
Despejando a $\displaystyle {{T}_{2}}$
Nos queda
$\displaystyle {{T}_{2}}=\frac{{{P}_{2}}{{T}_{1}}}{{{P}_{1}}}$
Ahora sustituimos nuestros datos.
$\displaystyle {{T}_{2}}=\frac{(760mmdeHg)(308{}^\circ K)}{440mmdeHg}=532{}^\circ K$
Pero nos piden el resultado en °C, por lo que restaremos 273 a la cantidad resultante en grados Kelvin.
$\displaystyle {{T}_{2}}=532{}^\circ K-273=259{}^\circ C$
Como podemos observar en las condiciones iniciales del problema, la temperatura aumentó y como resultado también la presión, esto quiere decir que hemos resuelto el problema con éxito.
Veamos otro ejemplo:
Solución: Para este ejemplo podemos observar claramente que la variable que nos hace alta es la presión final, por lo que haremos una recopilación de nuestros datos y empezar a resolver.
Si hacemos el análisis también nos damos cuenta que la temperatura ha aumentado de 45°C a 125°C esto quiere decir que por la proporcionalidad que existe entre la presión y temperatura, la presión aumentará como resultado final, no sabemos en que cantidad, pero si sabemos que aumentará.
¡Muy importante! y vuelvo a repetirlo, la temperatura siempre será en escala absoluta, es decir grados Kelvin.
Datos:
$\displaystyle {{P}_{1}}=$ 460 mm de Hg.
$\displaystyle {{T}_{1}}=$ 45°C + 273 = 318 °K
$\displaystyle {{P}_{2}}=$ ?
$\displaystyle {{T}_{2}}=$ 125°C + 273 =398°K
Por fórmula tenemos
$\displaystyle \frac{{{P}_{1}}}{{{T}_{1}}}=\frac{{{P}_{2}}}{{{T}_{2}}}$
Despejando $\displaystyle {{P}_{2}}$
Nos queda
$\displaystyle {{P}_{2}}=\frac{{{P}_{1}}{{T}_{2}}}{{{T}_{1}}}$
Reemplazando nuestros datos en la fórmula
$\displaystyle {{P}_{2}}=\frac{(460mmdeHg)(398{}^\circ K)}{318{}^\circ K}=575.72mmdeHg$
Pero, para entenderlo mejor sigamos viendo un tercer ejemplo más 😎
Solución: Anotemos los datos de nuestro problema y veamos las variables que tenemos y la que nos hace falta, recordemos mantener a la temperatura en su escala absoluta, por lo que tenemos que convertir a Kelvin.
$\displaystyle {{P}_{1}}=2atm$
$\displaystyle {{T}_{1}}=27{}^\circ C$
$\displaystyle {{P}_{2}}=3atm$
$\displaystyle {{T}_{2}}=?$
Convertimos a la temperatura 1, en absoluta, quedando así:
$\displaystyle {{T}_{1}}=27+273=300{}^\circ K$
Ahora, nos damos cuenta que nos hace falta la temperatura final, o T2, por lo que procedemos a realizar el despeje de la fórmula.
$\displaystyle {{T}_{2}}=\frac{{{P}_{2}}{{T}_{1}}}{{{P}_{1}}}$
Sustituyendo en nuestros datos:
$\displaystyle {{T}_{2}}=\frac{{{P}_{2}}{{T}_{1}}}{{{P}_{1}}}=\frac{(3atm)(300{}^\circ K)}{2atm}=450{}^\circ K$
Por lo que la temperatura aumentó a 450°K, por lo que tiene lógica, ya que si vemos el aumento de la temperatura, se debe al aumento de la presión.
Solución: Nuevamente debemos recopilar nuestros datos, y a su vez recordar en convertir la temperatura que está en Celcius y pasarlas a Kelvin, así que aquí vamos.
$\displaystyle {{P}_{1}}=4atm$
$\displaystyle {{T}_{1}}={{47}^{{}^\circ }}C$
$\displaystyle {{P}_{2}}=?$
$\displaystyle {{T}_{2}}=127{}^\circ C$
Pasando a temperatura absoluta a nuestras temperaturas tenemos que:
$\displaystyle {{T}_{1}}=47+273=320{}^\circ K$
$\displaystyle {{T}_{2}}=127+273=400{}^\circ K$
Ahora despejamos de nuestra fórmula a la presión final o P2.
$\displaystyle {{P}_{2}}=\frac{{{P}_{1}}{{T}_{2}}}{{{T}_{1}}}=\frac{(4atm)(400{}^\circ K)}{320{}^\circ K}=5atm$
Por lo que la presión final es de 5 atmósferas ¿complicado?, seguro que no, no es complicado. Recuerda practicar y resolver más ejercicios para que aprendas de una vez por todas. 😎
? Ejercicios para Practicar de Gay - Lussac
Resuelva los siguientes ejercicios y compruebe los resultados paso a paso haciendo click en la parte “ver solución”. ??
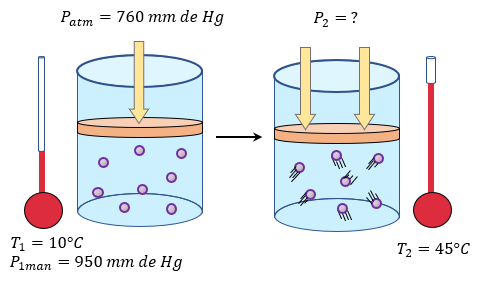
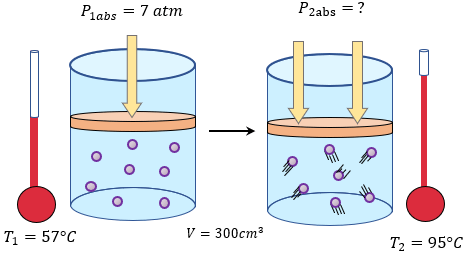
-
Hola, solo quería dar las gracias por la ayuda que me has dado, estos ejercicios me están sirviendo de mucho para recuperar Física y Química, aunque aún no he hecho el examen, gracias a estos ejercicios voy mejorando poco a poco. ¡Resultas hasta mejor que un profesor particular!
Att:
Claudia.
-
Y desde ya muchas gracias
-
Hola soy de secundaria de segundo año podrias darme un ejemplo no tan avanzado por favor
Me encanto todo muy buena info. -
hola, podrías ayudarme con este problema por favor?
un recipiente sellado e indeformable de oxigeno se encuentra a 80°C con una presión de 2500 KPa, si se sumerge en agua con hielo (0°C), ¿cuanto baja la presión del oxigeno cuando llegue a 0°C?
gracias -
Hola, me parece muy bueno este articulo pero me parece que le falta un signo de interrogación en el segundo problema.
171 Deja tu comentario
Deja una respuesta

Estos temas te pueden interesar