Solución Problema 1 de La Ley de los Gases Ideales
En este ejemplo de los problemas resueltos para ejercicios de práctica del tema de Ley de los gases ideales, es importante tener en cuenta el uso correcto de la fórmula, es por eso que se realizan los ejercicios paso a paso con su solución correspondiente. Recuerde que con este tipo de ejemplos el alumno podrá corroborar su respuesta y verificar si ha llegado al mismo resultado. ??
Nivel de Dificultad: ⭐⭐
Solución:
Para poder solucionar este problema de la ley de los gases ideales, basta con captar todos los datos que nos proporcionan como la cantidad de gramos de oxígeno, así como saber a cuánto equivale la masa molar del oxígeno, sabiendo que se trata de dos moléculas, es decir 32 gramos. También contamos con la temperatura, y volumen. Nos piden calcular el valor de la presión ejercida de la sustancia, así que no será tan complicado de resolver.
- Obtener el valor de la presión ejercida por la sustancia.
Datos:
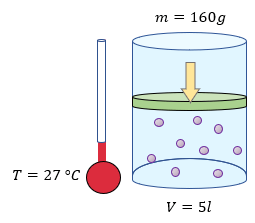
$latex \displaystyle m=160g$
$latex \displaystyle PM=32$
$latex \displaystyle R=0.0821\frac{atm\cdot l}{mol\cdot K}$
$latex \displaystyle T=27{}^\circ C+273=300K$
$latex \displaystyle V=5l$
a) Obtener la presión ejercida por la sustancia
No contamos con la cantidad de moles "n" de la sustancia, pero la podemos obtener empleando la siguiente fórmula:
$latex \displaystyle n=\frac{m}{PM}=\frac{160g}{32\frac{g}{mol}}=5mol$
Por lo que tenemos la cantidad de 5 moles, ahora si podemos seguir con nuestro cálculo
De la ecuación de los gases ideales, tenemos:
$latex \displaystyle PV=nRT$
Despejamos a la presión:
$latex \displaystyle P=\frac{nRT}{V}$
Sustituyendo los datos en la fórmula:
$latex \displaystyle P=\frac{nRT}{V}=\frac{\left( 5mol \right)\left( 0.0821\frac{atm\cdot l}{mol\cdot K} \right)\left( 300K \right)}{5l}=24.63atm$
Obtenemos un resultado de 24.63 atmósferas
Resultado:
$latex \displaystyle P=24.63atm$
-
Excelentes ejemplos.
Pueden poner más ejemplos.
Poner problemas para calcular la masa en con esta formula. -
tenia duda de la ecuacion de estado que se ocupa para un gas perfecto. pero ahora veo que es la misma de un gas ideal PV = nRT
-
Gracias, excelente comparación y ejemplos
Deja una respuesta

Excelentes ejemplos y muy ilustrativos para los estudiantes y para nuestra superación.